溶解度是指在一定温度和压力下,溶质在溶剂中的最大溶解量。溶解度的计算是化学领域中一项重要的实验和理论工作,它对于理解物质在溶液中的行为具有重要意义。本文将介绍溶解度计算的方法和相关概念。
【1】溶解度的定义
溶解度是指在一定温度和压力下,溶质在溶剂中的最大溶解量。它通常用溶质的摩尔分数或质量分数来表示。溶质的溶解度与溶液的浓度紧密相关,可以通过实验手段来测定。

【2】饱和溶解度
饱和溶解度是指在特定温度和压力下,溶质在溶剂中的最大溶解量。当溶质与溶剂之间的相互作用力相等时,溶质的溶解度达到最大值,此时称为饱和溶解度。
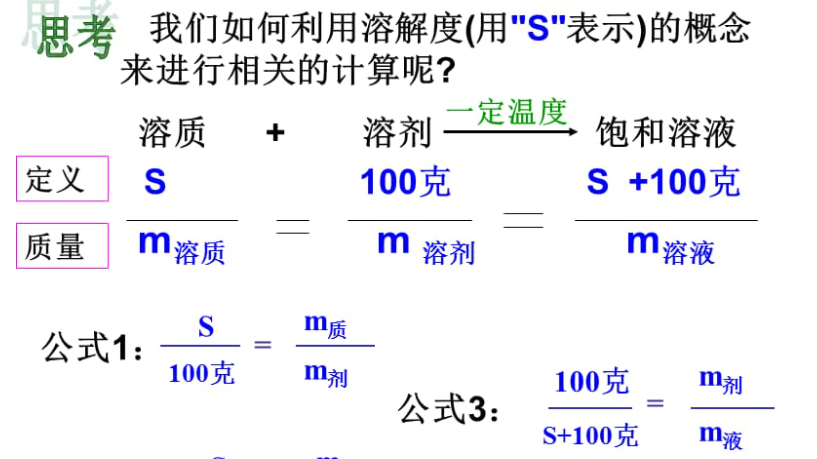
【3】溶解度计算方法
可以通过实验手段测定溶质的溶解度,也可以通过理论计算来推算。常用的溶解度计算方法有以下几种:
(1)摩尔溶解度计算方法:通过实验测定摩尔溶解度可以得到溶质在溶液中的摩尔分数。然后,根据溶液的浓度及摩尔质量规定溶质的质量或摩尔分数,即可计算溶解度。
(2)质量溶解度计算方法:通过实验测定溶液中溶质的质量浓度,即可求得溶质的质量溶解度。将溶质的质量溶解度转化为摩尔溶解度,用于溶解度的计算。
(3)化学动力学方法:通过研究溶液的溶解动力学行为,如溶质的溶解速率等,从而推测溶质的溶解度。
【4】计算示例
以氯化钠(NaCl)在水中的溶解度计算为例。已知氯化钠的摩尔质量为58.44 g/mol,对于25℃下饱和溶液,其溶质摩尔分数为0.357 mol/L。根据摩尔溶解度计算方法,可以得到氯化钠的溶解度为:
(0.357 mol/L) * (58.44 g/mol) = 20.85 g/L
【5】溶解度的影响因素
溶解度受多种因素影响,如溶剂的性质、温度和压力等。一般来说,溶解度随温度的升高而增加,而随压力的增加而减小。溶剂的极性也会影响溶液的溶解度。
【6】应用和意义
溶解度的计算对于研究物质在溶液中的行为具有重要意义。它不仅广泛应用于实际工程领域,如化工、冶金等,还对药物、食品等的研究和制备过程中的溶解度控制有着重要作用。溶解度的计算还为新化合物的合成和结晶提供了参考依据。
【总结】
溶解度计算是化学领域中一项关键的实验和理论工作。它可以通过多种方法进行计算,如摩尔溶解度计算、质量溶解度计算和化学动力学方法。溶解度受多种因素影响,如溶剂性质、温度和压力等。溶解度的计算对于理解物质在溶液中的行为、实际工程应用和科学研究都具有重要意义。