在化学反应中,离子键和共价键是两种常见的化学键类型。它们在原子间的相互作用方式不同,因此在性质和特点上也存在明显的区别。本文将从键的形成、性质和特点等方面对离子键和共价键进行比较。
离子键和共价键是两种不同类型的化学键。离子键是由两种离子间的相互吸引力形成的,而共价键则是由原子间的共享电子形成的。下面我们从三个方面分析离子键和共价键的区别。
1. 键的形成方式
离子键的形成是通过离子间的静电作用来实现的。在化合物中,金属原子会失去电子变成正离子,非金属原子会获得电子成为负离子,正负离子之间通过相互吸引形成离子键。例如,在氯化钠中,氯原子接受了钠原子失去的电子,形成了Na+和Cl-离子,它们之间通过静电作用形成了离子键。
共价键的形成是通过原子间的电子共享来实现的。在共价键中,两个原子共享一个或多个电子对,这样两个原子之间就会形成共价键。例如,在氢气分子(H2)中,两个氢原子通过共享一对电子形成了共价键,使得氢原子的外层电子填满,形成稳定的氢气分子。
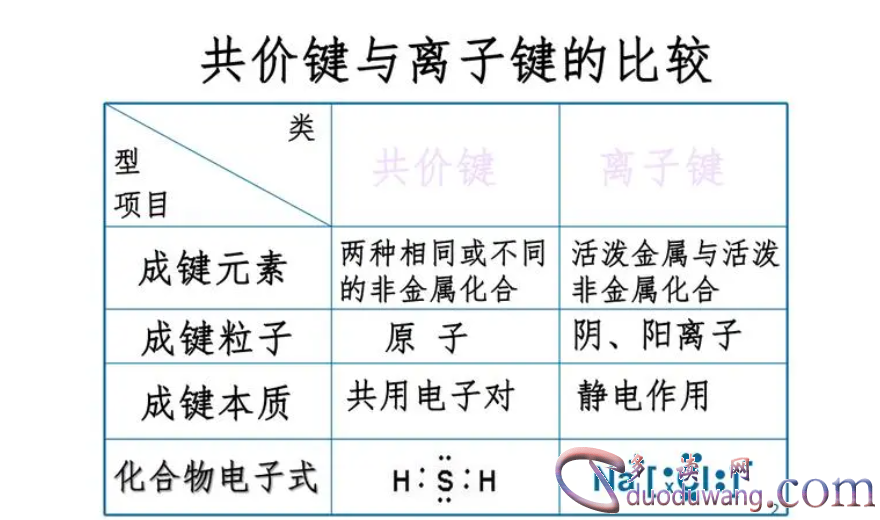
2. 化合物性质的差异
离子键通常形成在金属与非金属之间,这种化合物通常具有高熔点、离子性强、易溶于水等性质。由于离子键的形成需要离子间的静电相互吸引,所以离子化合物在固态中通常为晶体结构,容易形成晶体格点,呈透明或带色。例如,氯化钠是一种典型的离子化合物,具有高熔点、易溶于水等特点。
共价键通常形成在非金属原子之间,这种化合物通常具有较低的熔点、共价性强、不溶于水等性质。由于共价键是原子间的电子共享形成的,共价化合物通常是分子结构,分子间的相互作用力相对较弱。例如,氧气(O2)是一种典型的共价化合物,具有低熔点、不易溶于水等特点。
3. 化合物的导电性
离子化合物通常在熔融或溶液状态下能导电,因为离子在液态中能够移动,导致液体具有电导性。但在固态中,由于离子固定在晶体结构中,所以离子化合物通常不导电。例如,氯化钠在固态中是不导电的,但在熔融或溶液状态下能导电。
共价化合物通常是不导电的,因为共价键中电子完全属于原子间共享,没有自由电子可导电。除非共价化合物在其中加入杂质或施加高温等条件下才有可能导电。例如,纯净的水是不导电的,但如果加入少量盐类溶解物,则具有一定的导电性。
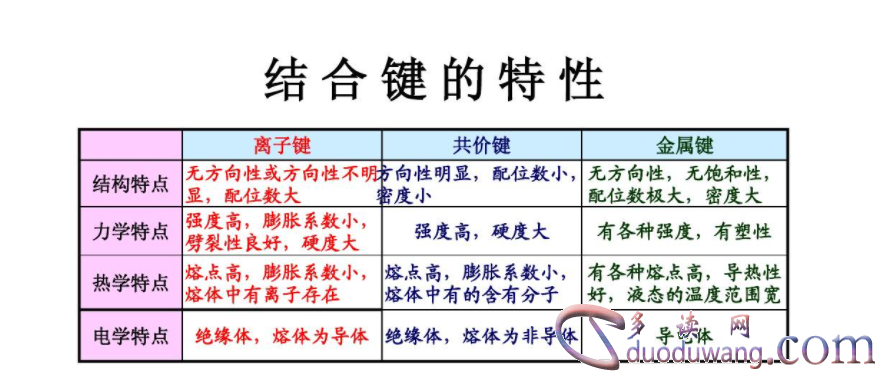
总结:离子键和共价键是两种常见的化学键类型,它们在形成方式、性质和特点上存在明显的区别。通过对离子键和共价键的比较,可以更好地理解不同类型的化学键对化合物性质的影响,为化学研究提供重要参考。